Kimyasal Türler Arası Etkileşimler Hakkında
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER
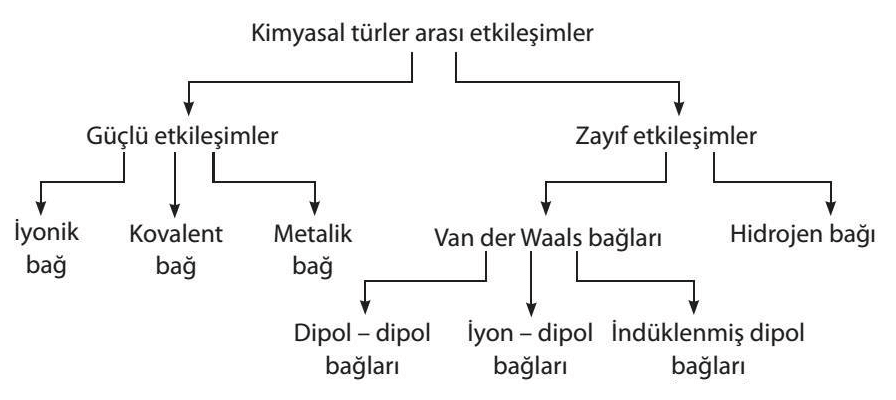
Kimyasal türler arası etkileşimler, iki farklı şekilde incelenmektedir. Bunlardan birincisi güçlü etkileşimler olurken ikincisi ise zayıf etkileşimler olarak ifade edilebilir.
Zayıf etkileşimler;
- Moleküller arası ortaya çıkan kuvvettir.
- Fiziksel bağlardır.
- Fiziksel bağ oldukları için fiziksel özellik belirler.
- Zayıf etkileşimlerin kopması kolaydır.
- Bağ enerjileri düşüktür.
Zayıf etkileşimler de kendi içerisinde ikiye ayrılmaktadır. Birincisi Van der Waals Kuvvetleri ikincisi ise Hidrojen Bağları olarak ifade edilebilir.
Güçlü etkileşimler;
- Atomlar arası ortaya çıkan kuvvettir.
- Kimyasal bağlardır.
- Kimyasal bağ oldukları için kimyasal özellik belirler.
- Güçlü etkileşimlerin kopması zordur.
- Bağ enerjileri yüksektir.
Güçlü etkileşimler ise kendi içerisinde üçe ayrılmaktadır. Kovelent Bağ, İyonik Bağ ve Metalik Bağ güçlü etkileşimlere örnek olarak verilebilmektedir.
Güçlü Etkileşimler:
1)İyonik Bağ:
İyonik bağı oluşturan tanecikler, ilk önce iyonları oluşturur, oluşan bu iyonlar arasındaki elektrostatik çekim kuvveti ile bağ meydana gelir. Metal atomları elektron vermeye, ametal atomları ise elektron almaya daha yatkındır. Metal atomları elektron vererek + (pozitif), ametal atomları ise elektron alarak – (negatif) yüklenirler. Bu elektron alışverişlerinde tanecikler daha kararlı hale gelmeyi amaçlarlar. Oluşan bu zıt yüklü iyonlar birbirlerini çekerek İyonik bağı oluşturur.
a)Atomların ve İyonların Lewis Elektron Nokta Yapıları:
Lewis yapısı, bir element sembolü ile son katman (değerlik) elektronlarının sayısını gösteren noktalardan oluşur. Bir atomun Lewis yapısı aşağıdaki şekilde yazılır:
1. Elementin katman elektron dizilimi yazılır.
2. Son katmandaki elektron sayısı bulunur.
3. Element sembolü yazılır.
4. Element sembolününün çevresine değerlik elektron sayısı ka-
dar nokta konur.
Örnek Soru:

b)İyonların Lewis Elektron Nokta Yapıları:
İyonların Lewis Elektron Nokta Yapıları Atomlar kararlı hale gelmek için kendilerine en yakın soy gaz elekt- ron düzenine ya da kararlı elektron dağılımına ulaşmak ister. Bunun için metaller son katmanlarındaki elektronlarını vererek ametaller ise son katmanlarına elektron alarak soy gaz elektron düzenine ulaşmak ister. Helyumun son katmanında iki, diğer soy gazların son katmanında se- kiz elektron bulunur. Atomların bağ yaparken son katmanını 2 elektrona tamamlamasına dublet kuralı, son katmanını 8 elektrona tamamlaması- na oktet kuralı denir. Metaller oktet ya da dublete ulaşırken son katman elektronlarını verdiği için, metal iyonlarının Lewis elektron-nokta yapısın- da atomun sembolü etrafında noktalar yer almaz. Verdiği elektron sayısı kadar elektriksel yük sembolün sağ üst köşesine (+) olarak yazılır.
Ametal iyonlarının Lewis elektron-nokta yapısı yazılırken son katman elektronları noktalarla gösterilir. Aldığı elektron sayısına eşit (-) elektrik- sel yük sembolün sağ üst köşesine yazılır. İyonların Lewis elektron nokta yapılarına örnekler aşağıda verilmiştir. Sodyum atomunun katman elektron dağılımı
,,Na 2) 8)1)
Sodyum atomunun Lewis elektron nokta yapısı
Na.
c)İyonik Bileşik Kristali:

d)İyonik Bileşiklerin Formülleri:

e)İyonik Bağlı Bileşiklerin Özellikleri:
*Kristal yapılıdırlar, moleküler yapılı değillerdir.
*Oda koşullarında metal halindedirler.
*Erime noktaları yüksektir.
*Sert ve kırılgan yapılıdırlar.
*Katı halde elektrik akımını iletmezler, sıvı halde veya sulu çözelti halinde elektriği iletirler.
*Suda iyonlaşarak çözünürler.
*İçlerindeki iyonları oluştururlar.
f)İyonik Bileşiklerin Adlandırılması:
İyonik bileşiklerin adlandırılmasında biz 4 gruba ayırırız:
1)Metal+Ametal: 2)Metal+Kök: 3)Kök+Kök : 4)Kök+Ametal:
NaCl, KCl KNO3 NH4, NO3 NH4, Cl
2)Kovalent Bağ: Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir.
a)Apolar ve Polar Kovalent Bağ:
Apolar bağ, kutupsuz bağ demektir. Örneğin O2, N2, H2 molekülleri aynı cins atomlardan oluşmuş iki atomlu moleküllerdir ve bu atomlar arasındaki bağ apolar kovalent bağdır
Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir.


3)Metalik Bağ:
Metal atomlarını bir arada tutan güçlü etkileşimlere metalik bağ denir. Elektron denizi modeline göre;
• Metallerin değerlik elektronları kendisine ve etrafındaki metal atomlarına ait boş değerlik kabuklarında sürekli hareket ederek bir elektron denizi oluşturur.
• Değerlik elektronlarını kaybederek katyona dönüşen metal atomları bu elektron denizi içerisinde dağılmış durumdadır.
• Belli bir düzendeki bu katyonların her biri, etrafındaki tüm elektronları kendine doğru çeker. Bu çekim kuvvetleri sonucunda metal atomları aralarında metalik bağlar oluşur.
• Değerlik elektronlarının hareketli olmaları, metallerin elektrik ve ısıyı iyi iletmelerini, tel ve levha haline gelebilmelerini sağlar.
• Serbest elektronlar, üzerlerine düşen görünür ışığın tamamını absorplayarak yüksek enerjili katmana uyarılır. Bu yüksek enerjili katmandan kısa bir sürede eski enerji katmanına dönen elektron aldığı enerjiyi ışın olarak geri yayar. Bu durum metale parlaklık kazandırır.
Zayıf Etkileşimler:
• Zayıf etkileşimler genellikle moleküller arasındaki çekim kuvvetleridir.
• Fiziksel bağlardır. Bu etkileşimler sonucunda yeni kimyasal maddeler oluşmaz.
• Zayıf etkileşimler moleküler yapılı bileşiklerin ve asal gazların fiziksel halleri, çözünürlükleri, erime noktaları, kaynama noktaları ve buhar basıncı gibi fiziksel özelliklerini belirler.
• Molekülleri arasındaki çekim kuvvetleri nispeten büyük olan maddeler katı, çekim kuvvetleri daha zayıf olanlar sıvı veya gaz halde bulunur.
• Zayıf etkileşimler yaklaşık 40 kJ/mol'den daha az enerjili etkileşimlerdir.
1)Van der Waals Bağları:
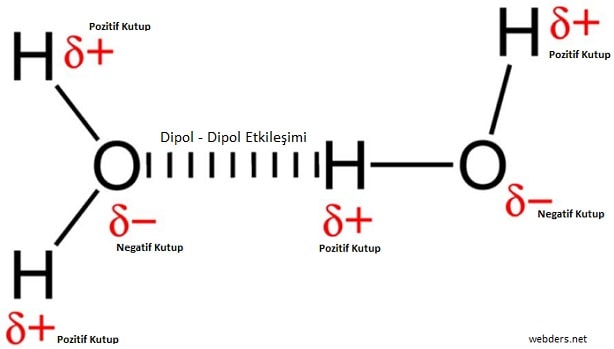
a)Dipol-Dipol Etkileşimleri:
• Polar bir moleküldeki kısmi pozitif yüklü bölge diğer molekülün kısmi negatif yüklü bölgesini elektrostatik çekim kuvveti ile çeker. Buna dipol-dipol etkileşimi denir.
• Bu kuvvetler metalik, iyonik veya kovalent bağa göre oldukça zayıf etkileşimlerdir.
b)İyon-Dipol Etkileşimleri:
• Bir iyon ile polar molekül arasında iyon-dipol etkileşimi gözlenir.
• Tüm iyonik bağlı bileşiklerin polar çözücülerdeki çözeltilerinde iyon-dipol etkileşimleri vardır.
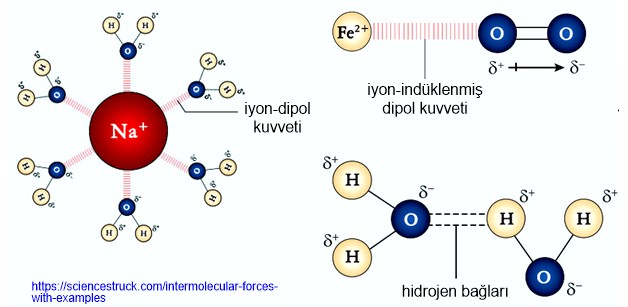
c)London Kuvvetleri (İndüklenmiş Dipol Bağları):
Maddenin yapısında bulunan elektronların etkileşimi sonucunda oluşan çekim güçleridir.
• Tüm maddelerde London çekim kuvvetleri görülür.
• Apolar moleküller ve soygazların sıvı ve katı hallerinde yalnızca London kuvvetleri görülür.
• Molekül kütlesi arttıkça (elektron sayısı arttıkça) London kuvvetleri artar, kaynama noktası artar.
• Organik moleküllerde dallanma arttıkça London çekim kuvvetleri azalır, kaynama noktası düşer.
2)Hidrojen Bağı:
Flor, oksijen ve azota (en elektronegatif atomlar) bağlı hidrojen içeren bileşiklerin molekülleri moleküller arasında hidrojen bağları görülür. Hidrojen bağları, F,O,N'a bağlı olan hidrojenin, komşu moleküldeki elektronegatif bir atom üzerindeki bağ yapmayan elektron çifti ile elektrostatik etkileşimi sonucunda oluşur.
Molekül kütlesi birbirine yakın maddelerde tanecikler arası etkileşimlerin büyükten küçüğe doğru sıralaması genellikle aşağıdaki şekildedir.
Hidrojen bağı > Dipol-dipol etkileşimleri > London kuvvetleri
FİZİKSEL VE KİMYASAL DEĞİŞİMLER
A)Fiziksel Değişimler:
• Maddenin dış görünümüyle ilgili olan özelliklere fiziksel özellikler denir.
• Renk, çözünürlük, özkütle, erime noktası, kaynama noktası, boyut, fiziksel hal, akışkanlık, yoğunluk, sertlik birer fiziksel özelliktir.
• Fiziksel özellikler, zayıf etkileşimlerin birer sonucudur.
• Fiziksel değişimler sırasında yaklaşık 40 kJ/mol'den daha az bir enerji değişimi olur.
Fiziksel değişimler sırasında;
• Maddeyi oluşturan taneciklerin türü, molekül yapısı, kimyasal özelliği ve maddenin iç yapısı değişmez.
Bazı fiziksel değişimler;
• Şekerin suda çözünmesi
• Metallerin elektriği iletmesi
• Camın kırılması
• Yoğurttan ayran yapılması
• Suyun donması
• Buzun erimesi
• Alkolün buharlaşması
• Su buharının yoğunlaşması
• Naftalinin süblimleşmesi
• Ham petrolün damıtılması
B)Kimyasal Değişimler:
• Maddenin iç yapısı ile ilgili olan özelliklere kimyasal özellikler denir.
• Bir maddenin oksijen ile tepkime verip vermeme asit ve bazlara karşı davranışları kimyasal özelliklerdir.
Kimyasal değişimler sırasında;
• Tanecik türü, iç yapısı, molekül yapısı, fiziksel özellikleri değişir.
• Hem güçlü etkileşimler hem de zayıf etkileşimler kopar.
• Kimyasal değişimler sırasında yaklaşık 40 kJ/mol'den daha fazla bir enerji değişimi olur.
Bazı kimyasal değişimler;
• Kağıdın yanması
• Demirin paslanması
• Solunum
• Fotosentez
• Elmanın çürümesi
• Asit ve bazların nötrleşmesi
• Sütten yoğurt eldesi
• Yoğurdun ekşimesi
• Yağlı boyanın kuruması
• Beton harcının sertleşmesi


